造血干细胞(HSCs)具有自我更新和多向分化潜能,能够产生各种类型的血液细胞,维持机体造血系统的平衡[1]。越来越多的研究表明,HSCs的稳态维持是一个复杂而精密的调控过程,涉及胞外和胞内多种调节因子[2-6]。深入了解有关HSCs的生物学功能是推动基于HSCs再生医学与临床治疗发展的关键。
p21由基因Cdkn1a编码,是一种包含164个氨基酸,分子量约为21 kDa的蛋白。它是细胞周期蛋白依赖性激酶抑制剂(CKI)家族的首个成员[7]。2000年,p21最早被报道作为限制HSCs进入细胞周期的关键分子[8]。然而,在研究不同遗传背景的小鼠时发现,p21基因全身敲除小鼠似乎并未展现出明显的造血系统功能异常[9-11]。另外,稳态条件下,p21在HSCs中的功能仍不清楚。
近日,细胞生态海河实验室程涛/程辉团队在《Protein & Cell》(IF=21.1)在线发布了题为“p21/Zbtb18 repress the expression of cKit to regulate the self-renewal of hematopoietic stem cells”的文章(细胞生态海河实验室为第一完成单位)。该研究利用p21-tdTomato小鼠发现,p21-tdT+ HSCs的功能强于p21-tdT– HSCs。p21可以与转录抑制因子Zbtb18相结合,协同抑制cKit的表达,从而调控HSCs的自我更新能力。这些发现不仅明确了稳态条件下p21在HSCs功能调节中的作用新机制,更揭示了p21作为CKI以外的角色。

尽管p21全身敲除小鼠在以往的研究中被广泛应用,但由于全身敲除小鼠模型存在的固有缺陷可能会对揭示p21在HSCs中真正发挥的作用产生影响。该研究使用p21-tdTomato小鼠,在不敲除p21基因的条件下,根据tdTomato荧光强度区分p21-tdT−和p21-tdT+ HSCs,以此来阐明在生理条件下p21于HSCs中的功能。CellTrace Violet的实验结果表明,p21-tdT+ HSCs处于不活跃的细胞分裂状态,该结果首先肯定了p21在HSCs细胞周期调节中存在的作用。接下来,一系列体内外功能实验证实,p21-tdT+ HSCs无论是在稳态还是移植后应激条件下,均展示出更强的长期移植以及自我更新能力。随后,为揭示p21-tdT−和p21-tdT+ HSCs之间存在显著功能差异的分子机制,该研究对这两群细胞进行了RNA测序、染色体可及性测序及H3K4me1、H3K4me2、H3K4me3和H3K27ac组蛋白修饰的CUT&Tag实验。通过对以上生物信息学数据的综合分析及实验验证,发现转录抑制因子Zbtb18在p21-tdT+ HSCs中高表达。最后,通过Zbtb18 CUT&Tag、体外敲降、Co-IP及Luciferase等实验,发现p21可以和Zbtb18结合共同抑制靶基因cKit的转录,从而使得p21-tdT+ HSCs具有更强的干细胞功能[6]。
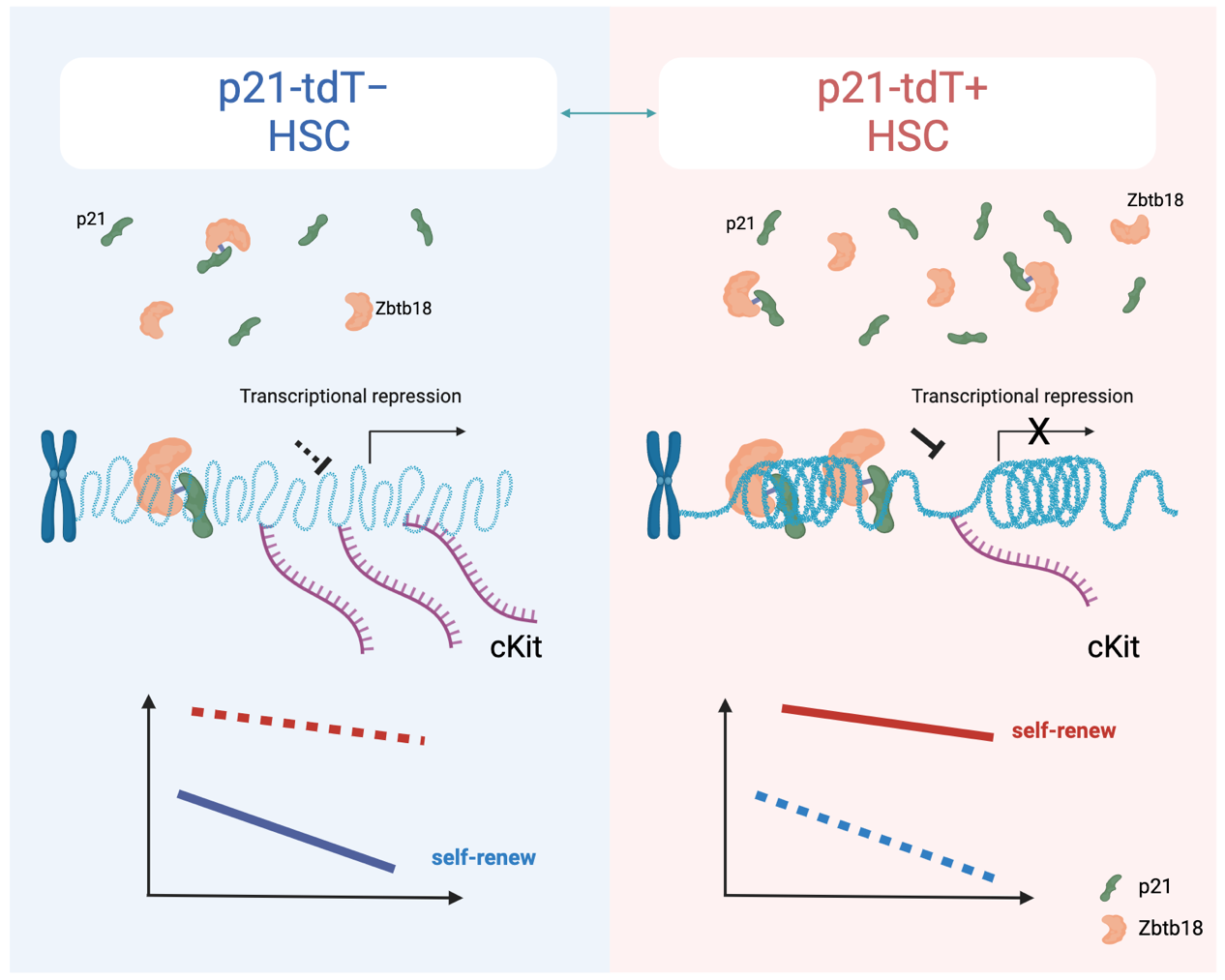
综上所述,该研究使用p21-tdTomato小鼠模型,探究了p21在稳态条件下于HSCs中的作用。该研究发现p21可以和转录抑制因子Zbtb18相结合,共同抑制cKit基因转录,从而使p21-tdT+ HSCs具有更强的长期移植以及自我更新能力。该发现为p21在HSCs中发挥着独立于细胞周期调控的生理功能与机制提供了新的视角,拓展了人们对于p21功能的理解,具有重要的生物学意义。
细胞生态海河实验室程辉教授、程涛教授、暨南大学鞠振宇教授和细胞生态海河实验室董芳教授为共同通讯作者,团队成员王妮妮和杨尚达为共同第一作者。该研究获得细胞生态海河实验室创新基金、国家重点研发计划、国家自然科学基金和中国医学科学院医学与健康科技创新工程等的支持。
原文链接:
https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwae022/7667517?login=true&utm_source=advanceaccess&utm_campaign=proteincell&utm_medium=email
参考文献:
1. Cheng, H., Z. Zheng,T. Cheng, New paradigms on hematopoietic stem cell differentiation. Protein Cell, 2020. 11(1): p. 34-44.
2. Morrison, S.J.D.T. Scadden, The bone marrow niche for haematopoietic stem cells. Nature, 2014. 505(7483): p. 327-34.
3. Itkin, T., et al., Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature, 2016. 532(7599): p. 323-8.
4. Sanjuan-Pla, A., et al., Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature, 2013. 502(7470): p. 232-6.
5. Yamazaki, S., et al., Nonmyelinating Schwann cells maintain hematopoietic stem cell hibernation in the bone marrow niche. Cell, 2011. 147(5): p. 1146-58.
6. Shin, J.Y., et al., High c-Kit expression identifies hematopoietic stem cells with impaired self-renewalmegakaryocytic bias. J Exp Med, 2014. 211(2): p. 217-31.
7. Harper, J.W., et al., The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases. Cell, 1993. 75(4): p. 805-16.
8. Cheng, T., et al., Hematopoietic stem cell quiescence maintained by p21cip1/waf1. Science, 2000. 287(5459): p. 1804-8.
9. van Os, R., et al., A Limited role for p21Cip1/Waf1 in maintaining normal hematopoietic stem cell functioning. Stem Cells, 2007. 25(4): p. 836-43.
10. Foudi, A., et al., Analysis of histone 2B-GFP retention reveals slowly cycling hematopoietic stem cells. Nat Biotechnol, 2009. 27(1): p. 84-90.
11. Matsumoto, A., et al., p57 is required for quiescencemaintenance of adult hematopoietic stem cells. Cell Stem Cell, 2011. 9(3): p. 262-71.
撰稿:程 辉 王妮妮 杨尚达
编辑:赵婉婉
校对:张婷婷
审核:祁健伟 郝 莎



