目前,高危多发性骨髓瘤(MM)患者生存仍然较差,对高危的定义尚无统一定论[1]。t(14;16)和t(14;20)染色体易位分别导致c-MAF和MAFB原癌基因表达上调,促进骨髓瘤细胞的异常增殖。由于t(14;16)和t(14;20)染色体易位的发生率较低,且常常伴随其他高危遗传学异常的出现,评价其独立预后意义非常困难[2,3]。美国阿肯色大学曾通过mRNA表达谱分析发现,包含t(14;16)和t(14;20)在内的MAF易位组具有相似的基因表达模式,并与MM早期复发相关。然而,尚缺少大的队列研究探讨MAF易位在初诊MM患者中的预后价值。
近日,细胞生态海河实验室安刚/邱录贵团队在《Haematologica》(IF=10.1)在线发布了题为“MAF translocation remains a strong prognostic factor despite concurrent chromosomal abnormalities”的文章(细胞生态海河实验室为第一完成单位)。该研究基于中国首个前瞻纵向血液病队列,比较初诊时携带和不携带t(14;16)/t(14;20)的MM患者的生存情况,揭示了MAF易位在初诊MM患者中的重要预后价值。

该研究共纳入2013年1月至2021年6月间于中国医学科学院血液病医院(中国医学科学院血液学研究所)就诊的830例初诊时具有完整的荧光原位杂交的细胞遗传学数据的MM患者,其中34例患者携带t(14;16)/t(14;20)。
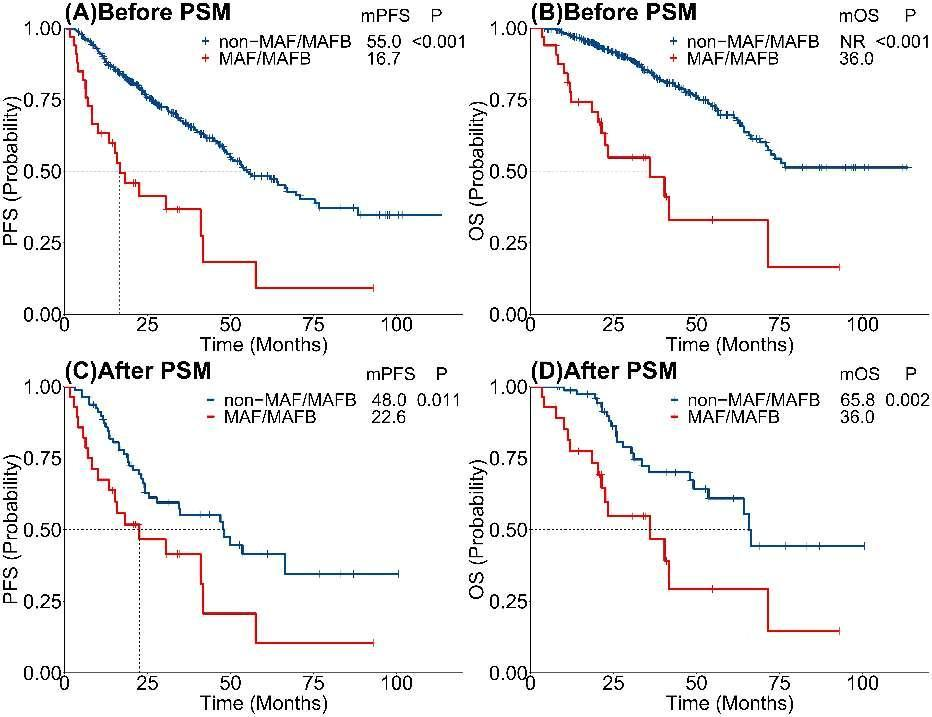
结果表明,初诊时携带t(14;16)/t(14;20)的MM患者预后显著不佳,并且在不伴有或伴有其他高危遗传学异常的亚组中,携带t(14;16)/t(14;20)的患者具有明显更差的预后。此外,该研究利用倾向性评分匹配,得到一组同样具有高危遗传学异常且基线均衡的对照组,进一步验证了t(14;16)/t(14;20)的不良预后价值。MM国际分期系统的第二次修订(R2-ISS)未将t(14;16)/t(14;20)列为高危遗传学因素,但该研究数据表明t(14;16)/t(14;20)加入到R2-ISS中可以优化预后分层。
综上,该研究发现,尽管在MM患者中MAF易位常常合并其他高危遗传学因素出现,但其仍然是MM的重要预后因素,强调了将t(14;16)/t(14;20)纳入预后分层系统的重要性。
细胞生态海河实验室安刚教授和邱录贵教授为共同通讯作者。团队成员刘昀彤和吕瑞为共同第一作者。
原文链接:https://doi.org/10.3324/haematol.2023.284666
参考文献:
1. Davies, F.E., et al., Perspectives on the Risk-Stratified Treatment of Multiple Myeloma. Blood Cancer Discov, 2022. 3(4): p. 273-284.
2. Avet-Loiseau, H., et al., Translocation t(14;16)multiple myeloma: is it really an independent prognostic factor? Blood, 2011. 117(6): p. 2009-11.
3. Ross, F.M., et al., The t(14;20) is a poor prognostic factor in myeloma but is associated with long-term stable disease in monoclonal gammopathies of undetermined significance. Haematologica, 2010. 95(7): p. 1221-5.
撰稿:刘昀彤 吕 瑞 安 刚
编辑:赵婉婉
校对:张婷婷
审核:祁健伟 周家喜



