随着现代生活节奏的加快和饮食习惯的改变,脂肪肝成为了一种越发普遍的健康问题,尤其是在快速城市化和生活水平提高的背景下。脂肪肝,尤其是非酒精性脂肪肝(NAFLD)[1],影响了全球数亿人的健康。它主要表现为过量脂肪在肝细胞中的积累,这不仅与饮食高热量密切相关,还与身体的代谢过程有关[2-4]。
2024年2月15日,细胞生态海河实验室黄波教授团队在《Science》(IF=56.9)在线发表了题为“Hepatic glycogenesis antagonizes lipogenesis by blocking S1P via UDPG”的论文。该研究为肝细胞如何精确处理葡萄糖的储存提供全新视角,有望为非酒精性脂肪肝的治疗提供新思路。

葡萄糖进入细胞后,在葡萄糖激酶作用下生成G6P,G6P可以在葡萄糖磷酸变位酶1(Pgm1)的作用下生成G1P,再经UDP-葡萄糖焦磷酸化酶2(UGP2)催化生成UDPG,UDPG则在糖原合酶(GYS)催化下,将葡萄糖转交给已有的糖原,生成n+1糖原(n代表葡萄糖的数目),从而将进食的葡萄糖以糖原的形式进行存储。但是,G6P还可以经糖酵解途径生成丙酮酸,丙酮酸进入线粒体生成乙酰辅酶A,乙酰辅酶A经过中间转化,从线粒体进入到胞浆,直接合成脂肪酸,后者再与甘油结合生成甘油三酯,成为肝细胞储存葡萄糖的另一种方式。利用碳13同位素示踪及高效液相色谱质谱分析技术,黄波教授团队发现,在进食后,肝细胞中的葡萄糖优先转化为糖原,在糖原含量达到饱和之后才流向脂肪酸。
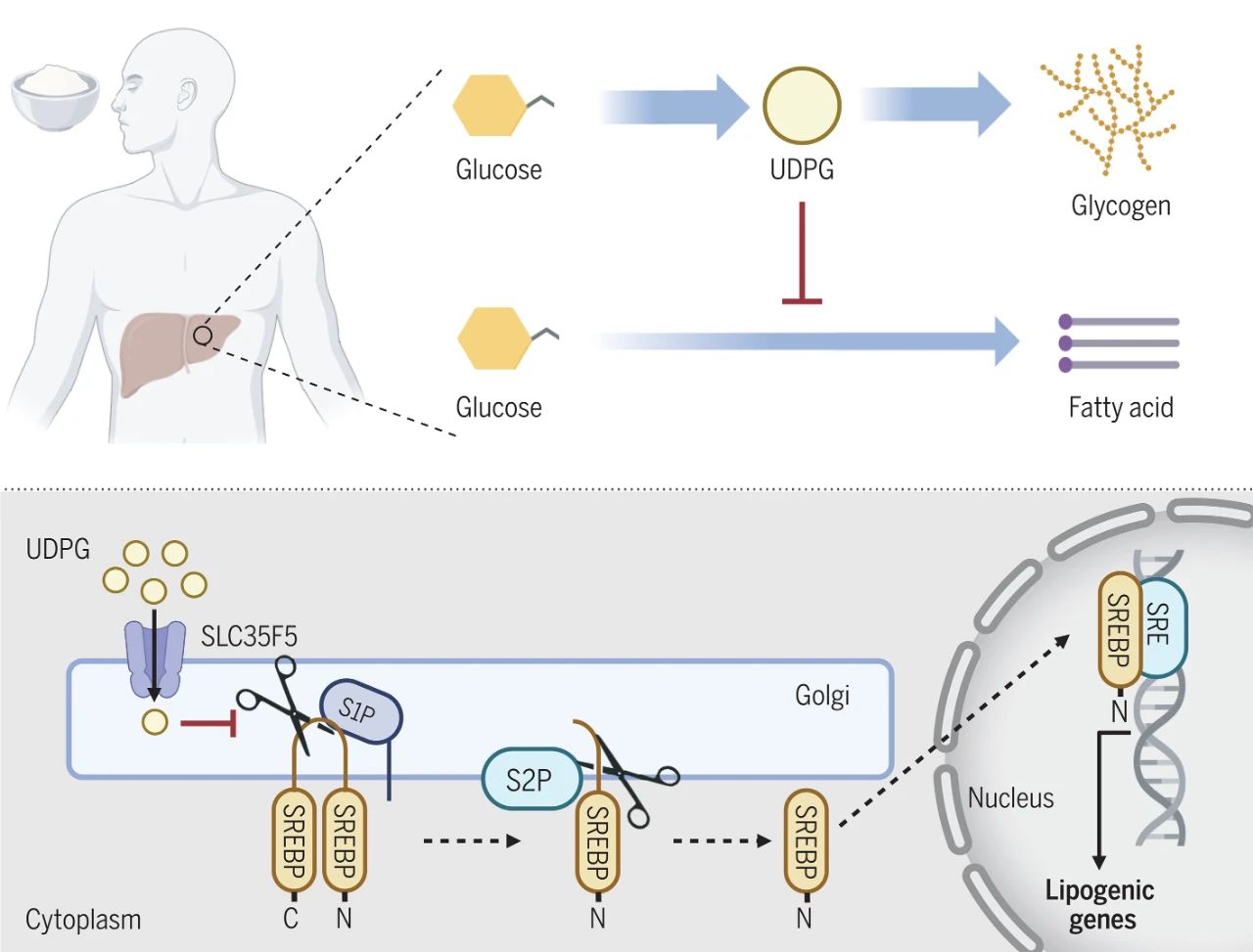
黄波教授团队的研究深入探讨了肝脏如何在糖原合成和脂肪生成之间做出选择的分子机制。他们发现,一个糖原合成过程中的中间产物UDPG在这一过程中发挥了关键作用。UDPG能够调节SREBP1c这一关键转录因子的激活。SREBP1c是一种位于内质网的跨膜蛋白,当在进食后,肝细胞SREBP1c由内质网被转运至高尔基体膜表面,分别接受高尔基体中的位点1蛋白水解酶(S1P)和位点2蛋白水解酶(S2P)的水解,产生的N-端片段则成为具有活性的转录因子,转录脂肪酸合成所需的各种代谢酶。团队研究发现,UDPG通过转运子SLC35F5进入高尔基体,直接与S1P结合,诱导S1P的泛素化降解,从而阻断活性形式SREBP1c的生成,最终抑制脂肪酸的合成。
利用这一机制,黄波教授团队还发现,通过UDPG的治疗可以显著减少脂肪肝模型小鼠的肝脏脂肪积累以及相关肝脏病变。这一发现不仅揭示了一个全新的调控肝脏能量代谢的机制,也为开发针对脂肪肝的治疗策略提供了新的靶点。
该研究得到了细胞生态海河实验室创新基金、中国医学科学院医学与健康科技创新工程等项目的资助。细胞生态海河实验室黄波教授为通讯作者,团队成员陈洁和周雅博为共同第一作者。
原文链接:https://www.science.org/doi/10.1126/science.adi3332
参考文献:
1. Lambert JE, Ramos-Roman MA, Browning JD, Parks EJ. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 2014;146(3):726-735.
2. Zhao Q, Liu J, Deng H, et al. Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output. Cell. 2020;183(1):76-93.e22.
3. Zhuge A, Li S, Yuan Y, et al. Microbiota-induced lipid peroxidation impairs obeticholic acid-mediated antifibrotic effect towards nonalcoholic steatohepatitis in mice. Redox Biol. 2023;59:102582.
4. Serviddio G, Bellanti F, Tamborra R, et al. Uncoupling protein-2 (UCP2) induces mitochondrial proton leakincreases susceptibility of non-alcoholic steatohepatitis (NASH) liver to ischaemia-reperfusion injury. Gut. 2008;57(7):957-965.
撰稿:陈 洁
编辑:赵婉婉
校对:张婷婷
审核:祁健伟 周家喜



