造血干细胞(HSC)通过自我更新和多向分化产生所有类型的血细胞,在人类整个生命周期中维持造血。目前,HSC移植广泛应用于治疗血液、免疫、遗传性以及恶性肿瘤等多种疾病,其发育和再生研究在整个干细胞领域发挥范式引领作用。造血发育过程复杂,胚胎时期涉及多个部位,包括卵黄囊、主动脉-性腺-中肾(AGM)、肝脏、胎盘、脐带等[1]。人HSC起源于CS14(妊娠后32天)AGM区的主动脉内造血簇(IAHCs)的IL33+ALDH1A1+动脉内皮细胞[1]。尽管IAHCs中有HSC,但是这些HSC功能不成熟很少用于移植。在CS17(妊娠后41天)HSC在肝脏中定植、成熟和扩增,11周左右开始定植骨髓,12周骨髓中出现可移植的HSC[2],20周之后骨髓是维持造血系统最重要的器官。以往对小鼠整个生命周期的HSC研究显示,HSC在不同的发育阶段具有显著的功能异质性[3]。而人胚胎早期造血发育阶段(CS12-15)的AGM区具有3种不同发育路径和分子特征的造血干祖细胞(HSPC),这与其所处微环境细胞调控密切相关[4]。因此,造血系统无论在胚胎还是出生后的阶段都经历了巨大的变化。
2022年12月8日,细胞生态海河实验室程涛教授、朱平教授和胡林萍副教授合作团队在《Developmental Cell》期刊在线发表了题为“Temporal molecular program of human hematopoietic stem and progenitor cells after birth”的研究论文(细胞生态海河实验室为第一完成单位)。该研究利用单细胞技术体系,全面和详细比较了出生后不同年龄阶段人HSPC转录组、表型和功能特征,首次揭示成体人HSPC发育规律,同时也为临床移植HSC质量控制标准奠定重要基础。
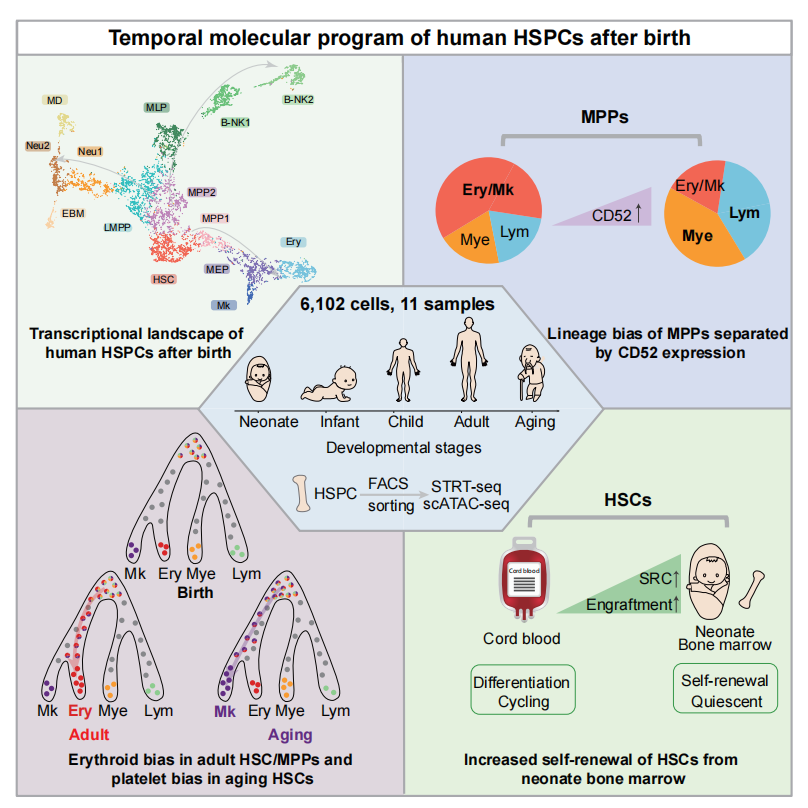
研究人员首先利用单细胞标记逆转录RNA测序法(STRT-seq)对不同年龄阶段(新生儿、婴儿、儿童、成人、老年)的骨髓HSPC细胞:HSC,MPP(人多潜能祖细胞),LMPP(淋系倾向多潜能祖细胞),MLP(多潜能淋系祖细胞),CMP(共同髓系祖细胞),GMP(粒-单核系祖细胞),MEP(巨核红系祖细胞)和B-NKP(B-NK祖细胞)进行单细胞转录组建库和深度测序,构建了人出生后骨髓HSPC发育分子图谱。通过系统解析发育图谱,揭示了人骨髓HSPC发育的分子动力学规律:HSC和髓系祖细胞(除GMP外)数量随年龄增长而增加,而淋系祖细胞数量下降,HSPC在发育后期出现髓系分化偏倚;在异质性方面,干祖细胞(HSC, MPP, LMPP)的异质性随着年龄增长逐渐增强,而谱系定向祖细胞(MEP, MLP, GMP, CMP)的异质性逐渐减弱,提示发育后期寡能/单能祖细胞定向谱系分化潜能增强。多能干祖细胞(HSC, MPP2, LMPP, MLP, MEP)在发育过程中表现出更剧烈的转录组改变,而定向祖细胞(B-NK2, Mk, Neu1, Neu2, MD, EBM)在转录上更稳定;大多数HSPC亚群在婴儿到儿童阶段发生了最剧烈的转录改变,提示HSPC的转录谱在出生后早期就已建立。不同HSPC亚群中改变的基因种类高度一致,即造血分子动态变化呈发育依赖式,差异更多是取决于发育阶段,与HSPC亚群种类关系甚微。在谱系分化方面,从出生到成年阶段HSPC红系分化潜能显著增强;从成年到老年阶段,衰老的HSC表现出明显的巨核/血小板偏倚。
进一步,通过解析MPP群体的异质性,精准鉴定出MPP1和MPP2新亚群,筛选并功能验证CD52作为分离红/巨核系偏向MPP1和髓/淋系偏向MPP2的有效分子标志物,且该特征在脐血MPP中具有普适性。
撰稿:张雅文 谢小韦 胡林萍
编辑:高佳佳
校对:何美曈
审核:祁健伟 周家喜



